Chaleur de vaporisation
Introduction
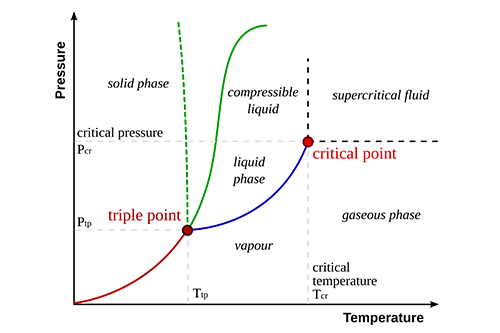
La chaleur de vaporisation est un concept fondamental de la thermodynamique et joue un rôle crucial dans divers processus naturels et industriels. Elle représente la quantité d'énergie nécessaire pour faire passer une substance de sa phase liquide à sa phase gazeuse sans modifier sa température. La compréhension de cette propriété est essentielle pour des applications allant de la science du climat aux systèmes d'ingénierie.
Formulation
La chaleur de vaporisation (ΔHvap) peut être considérée comme l'énergie nécessaire pour surmonter les forces intermoléculaires qui maintiennent le liquide ensemble. Contrairement à la capacité thermique spécifique, qui traite des changements de température, la chaleur de vaporisation concerne spécifiquement la transition de phase. Cette énergie est généralement mesurée en joules par gramme (J/g) ou en kilojoules par mole (kJ/mol).
L'eau et sa chaleur de vaporisation
L'eau possède une chaleur de vaporisation élevée par rapport à de nombreuses autres substances, ce qui a des implications importantes pour les systèmes environnementaux et biologiques. Cette propriété permet à l'eau de réguler efficacement la température par des processus tels que la transpiration des plantes. En outre, le ΔHvap élevé de l'eau contribue à son rôle dans les phénomènes météorologiques et la régulation du climat.
Exemples de chaleur de vaporisation
La chaleur de vaporisation varie considérablement d'une substance à l'autre. Par exemple
- Éthanol: ΔHvap inférieur à celui de l'eau, ce qui facilite sa vaporisation.
- Mercure: ΔHvap extrêmement élevé, nécessitant une énergie substantielle pour passer à l'état de gaz.
- Acétone: ΔHvap modéré, utilisé dans diverses applications industrielles en raison de sa volatilité.
Il est essentiel de comprendre ces différences pour sélectionner les matériaux et les conditions appropriés en génie chimique et dans d'autres domaines scientifiques.
Tableau des chaleurs de vaporisation
|
Substance |
Chaleur de vaporisation (kJ/mol) |
Utilisations courantes |
|
Eau |
40.7 |
Régulation du climat, processus biologiques |
|
Éthanol |
38.6 |
Solvant, carburant, boissons |
|
Mercure |
59.1 |
Thermomètres, applications électriques |
|
Acétone |
31.3 |
Solvant, dissolvant de vernis à ongles |
|
Benzène |
30.8 |
Fabrication de produits chimiques, solvants |
Pour plus d'informations, veuillez consulter le site Stanford Advanced Materials (SAM).
Questions fréquemment posées
Qu'est-ce que la chaleur de vaporisation ?
La chaleur de vaporisation est l'énergie nécessaire pour faire passer une substance de l'état liquide à l'état gazeux à température et pression constantes.
Pourquoi la chaleur de vaporisation de l'eau est-elle importante ?
La chaleur de vaporisation élevée de l'eau aide à réguler la température dans les systèmes naturels et biologiques par le biais de processus tels que la transpiration.
En quoi la chaleur de vaporisation diffère-t-elle d'une substance à l'autre ?
La chaleur de vaporisation varie d'une substance à l'autre en fonction de l'intensité des forces intermoléculaires, ce qui influe sur la quantité d'énergie nécessaire à la vaporisation.
La chaleur de vaporisation peut-elle être mesurée expérimentalement ?
Oui, elle peut être mesurée à l'aide de la calorimétrie, qui permet de quantifier l'énergie absorbée lors de la vaporisation.
Comment la chaleur de vaporisation est-elle appliquée dans l'industrie ?
Elle est utilisée pour concevoir des systèmes de refroidissement, des processus de distillation et pour comprendre les besoins en énergie pour les changements de phase dans diverses applications.