Comprendre le point triple en thermodynamique
Introduction
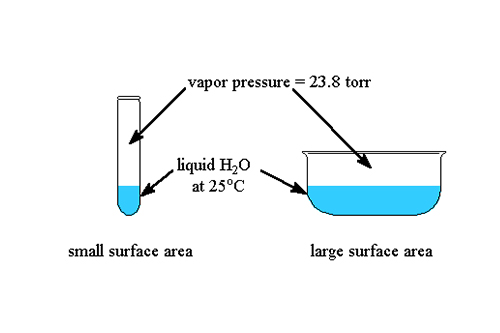
En thermodynamique, le point triple est un phénomène fascinant où une substance peut exister dans les trois phases - solide, liquide et gazeuse - à l'équilibre. Cette condition précise est essentielle pour définir les échelles standard de température et de pression et a des implications significatives dans divers domaines scientifiques.
Propriétés du point triple
Le point triple est caractérisé par des valeurs de température et de pression spécifiques, propres à chaque substance. À ce point, l'énergie cinétique des molécules permet aux trois phases de coexister sans qu'une phase ne domine les autres. Comprendre le point triple permet d'étudier les transitions de phase et le comportement des matériaux dans différentes conditions environnementales.
Point triple et point critique
Bien que le point triple et le point critique impliquent tous deux des transitions de phase, ils représentent des conditions différentes :
Caractéristique | Point triple | Point critique |
Phases coexistantes | Solide, liquide, gaz | Liquide et gaz seulement |
Température | Spécifique à chaque substance | Supérieure à la température du point triple |
Pression | Spécifique à chaque substance | Pression critique, au-delà de laquelle les phases liquide et gazeuse n'existent plus. |
Transition de phase | Équilibre entre trois phases | Transition entre les phases liquide et gazeuse |
Applications du point triple
Le point triple a des applications pratiques dans l'étalonnage des thermomètres, la normalisation des échelles de température et l'étude des propriétés des matériaux. Il sert de point de référence dans les expériences scientifiques et les processus industriels où un contrôle précis des états de phase est essentiel.
Le point triple dans la vie quotidienne
Bien qu'il ne soit pas couramment observé directement, le concept du point triple sous-tend des phénomènes tels que la formation de givre, la sublimation et le comportement de l'eau dans différents états. La compréhension du point triple est utile en météorologie, en sciences de l'environnement et dans les disciplines d'ingénierie.
Tableau des points triples
Voici un tableau indiquant les valeurs du point triple pour différentes substances. Le point triple est la température et la pression auxquelles les trois phases (solide, liquide et gazeuse) d'une substance coexistent en équilibre.
Substance | Température du point triple (°C) | Pression du point triple (Pa) |
Eau | 0.01 | 611.657 |
Dioxyde de carbone | -56.6 | 518.5 |
Hélium | -268.93 | 2.29 |
Azote | -210.00 | 1.4 × 10³ |
Oxygène | -218.79 | 1.5 × 10³ |
Soufre | 115.21 | 1.3 × 10⁶ |
Mercure | -38.83 | 2.0 × 10⁵ |
Ammoniac | -77.7 | 1.2 × 10⁶ |
Méthane | -182.5 | 1.0 × 10⁶ |
Argon | -189.34 | 1.0 × 10³ |
Pour plus d'informations, veuillez consulter le site Stanford Advanced Materials (SAM).
Questions fréquemment posées
Quel est le point triple de l'eau ?
Le point triple de l'eau se situe à 0,01°C et 611,657 pascals, là où la glace, l'eau liquide et la vapeur d'eau coexistent.
Comment le point triple est-il utilisé dans l'étalonnage de la température ?
Il sert de point de référence fixe pour l'étalonnage des thermomètres, ce qui garantit des mesures de température précises dans les applications scientifiques et industrielles.
Le point triple est-il présent dans toutes les substances ?
Oui, chaque substance pure possède son propre point triple, défini par des conditions de température et de pression spécifiques.
Quelle est la différence entre le point triple et le point de fusion ?
Le point de fusion fait référence à la température à laquelle un solide se transforme en liquide à une pression spécifique, tandis que le point triple implique la coexistence des phases solide, liquide et gazeuse.
Pourquoi le point critique est-il important en thermodynamique ?
Le point critique marque la fin de la frontière entre les phases liquide et gazeuse, au-delà de laquelle les phases liquide et gazeuse distinctes cessent d'exister, ce qui permet d'étudier les fluides supercritiques.