Diagrammes de phase : Types et exemples
Introduction aux diagrammes de phase
Les diagrammes de phase sont des outils essentiels en chimie et en science des matériaux. Ils fournissent une représentation graphique des états physiques d'une substance dans différentes conditions de température et de pression. Ces diagrammes aident les scientifiques et les ingénieurs à prévoir le comportement des matériaux au cours de processus tels que le chauffage, le refroidissement et la compression.
Les états de la matière
La compréhension des trois états primaires de la matière - solide, liquide et gazeux - est fondamentale pour l'interprétation des diagrammes de phase.
Solide
À l'état solide, les molécules sont étroitement emballées dans une structure fixe, ce qui leur confère une forme et un volume définis. Les solides ont une densité élevée et une entropie faible par rapport aux liquides et aux gaz.
Liquide
Les liquides ont un volume défini mais prennent la forme de leur contenant. Les molécules d'un liquide sont moins serrées que celles d'un solide, ce qui permet une certaine fluidité et une entropie plus élevée.
Gaz
Les gaz n'ont ni forme ni volume définis. Les molécules sont très espacées et se déplacent librement, ce qui entraîne l'entropie la plus élevée des trois états.
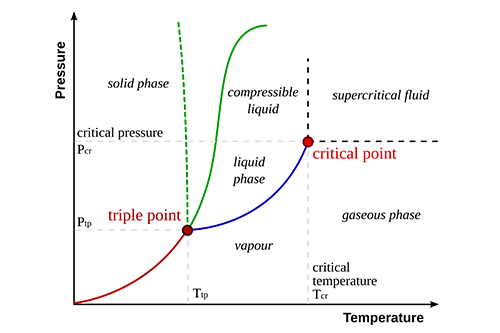
Principales caractéristiques des diagrammes de phases
Les diagrammes de phases présentent généralement plusieurs caractéristiques essentielles :
- Point triple : Ensemble unique de conditions dans lesquelles les phases solide, liquide et gazeuse coexistent en équilibre.
- Point critique : La température et la pression au-delà desquelles un gaz ne peut être liquéfié.
- Limites de phase : Lignes qui séparent différentes phases, indiquant les conditions dans lesquelles une phase se transforme en une autre.
Importance des diagrammes de phases
Les diagrammes de phases sont essentiels dans diverses applications, notamment dans les domaines suivants
- La science des matériaux : Conception de matériaux aux propriétés spécifiques en contrôlant leur phase au cours du traitement.
- Météorologie :compréhension des conditions atmosphériques et des schémas météorologiques.
- Génie chimique : Optimisation des réactions et des séparations en contrôlant la température et la pression.
Tableau des diagrammes de phase
|
Région de phase |
Caractéristiques |
Exemple de conditions |
|
Solide |
Forme et volume fixes, faible entropie |
Glace à 0°C et 1 atm |
|
Liquide |
Volume défini, la forme s'adapte au récipient |
Eau à 25°C et 1 atm |
|
Gaz |
Pas de forme ou de volume fixe, entropie élevée |
Vapeur d'eau à 100°C et 1 atm |
|
Point triple |
Les trois phases coexistent |
0,01°C et 0,006 atm pour l'eau |
|
Point critique |
Au-delà de ce point, les phases liquide et gazeuse sont indiscernables |
374°C et 218 atm pour l'eau |
Pour plus d'informations, veuillez consulter le site Stanford Advanced Materials (SAM).
Questions fréquemment posées
Quelles informations puis-je obtenir à partir d'un diagramme de phases ?
Un diagramme de phase montre la stabilité de différentes phases (solide, liquide, gaz) à différentes températures et pressions, ce qui permet de prédire le comportement des matériaux.
Quelle est l'importance du point triple dans les diagrammes de phases ?
Le point triple est l'endroit où les phases solide, liquide et gazeuse coexistent en équilibre, ce qui offre des conditions uniques pour l'étude des transitions de phase.
Que se passe-t-il au point critique d'un diagramme de phases ?
Au point critique, la distinction entre les phases liquide et gazeuse disparaît, ce qui donne un fluide supercritique aux propriétés uniques.
Les diagrammes de phases peuvent-ils être utilisés pour des mélanges ou uniquement pour des substances pures ?
Les diagrammes de phases peuvent être construits à la fois pour les substances pures et les mélanges, bien que les diagrammes pour les mélanges soient plus complexes en raison des variables supplémentaires.
Quelle est l'utilité des diagrammes de phases dans les applications industrielles ?
Ils aident à concevoir des processus tels que la cristallisation, la distillation et la synthèse de matériaux en prédisant les changements de phase dans différentes conditions.