Tout ce qu'il faut savoir sur les oxydes de titane
Introduction
Lesoxydes de titane sont des composés constitués de titane et d'oxygène, connus pour leurs propriétés remarquables et leurs applications variées. Ces oxydes se présentent principalement sous deux formes : le dioxyde de titane (TiO₂) et le monoxyde de titane (TiO). Cet article présente les caractéristiques, les méthodes de synthèse, les applications et l'impact environnemental des oxydes de titane.
Types d'oxydes de titane
1. Dioxyde de titane (TiO₂)
Le TiO₂ est une poudre blanche et inodore qui présente un indice de réfraction élevé et une forte absorption de la lumière UV. Il présente une activité photocatalytique, une stabilité chimique et n'est pas toxique.
Le TiO₂ existe sous trois formes principales : anatase, rutile et brookite. L'anatase et le rutile sont les plus courants, le rutile étant thermodynamiquement stable et l'anatase se transformant en rutile sous l'effet de la chaleur.

2. Monoxyde de titane (TiO)
Le TiO est moins courant, avec un éclat métallique et une conductivité électrique. Il a une structure de sel gemme et est souvent utilisé dans des applications spécialisées telles que les films minces et les revêtements.
Synthèse des oxydes de titane
1. Dioxyde de titane (TiO₂)
- Leprocédé au sulfate pour produire du TiO₂ consiste à faire réagir de l'ilménite (FeTiO₃) avec de l'acide sulfurique, ce qui produit du sulfate de titane. Ce composé est ensuite hydrolysé et calciné pour produire du dioxyde de titane.
- Une autre méthode, connue sous le nom de procédé au chlorure, implique la chloration de l'ilménite ou du rutile à des températures élevées pour former du tétrachlorure de titane (TiCl₄), qui est ensuite oxydé pour produire du TiO₂.
- Une approche plus moderne est la méthode sol-gel, où les alcoxydes de titane subissent une hydrolyse et une polymérisation, suivies d'un séchage et d'une calcination. Ce processus permet d'obtenir des nanoparticules de TiO₂ dont la taille et la morphologie sont contrôlées.
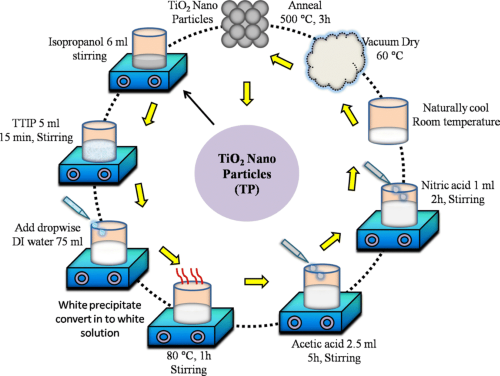 [1]
[1]
2. Monoxyde de titane (TiO)
La synthèse du monoxyde de titane (TiO) fait généralement appel à des méthodes de réduction. Le TiO est généralement produit en réduisant le TiO₂ avec de l'hydrogène ou par la combinaison directe du titane et de l'oxygène dans des conditions soigneusement contrôlées.
Applications des oxydes de titane
1. Dioxyde de titane (TiO₂)
- Pigments : Le TiO₂ est le pigment blanc le plus utilisé en raison de sa luminosité et de son opacité. Il est utilisé dans les peintures, les revêtements, les plastiques, le papier et les encres.
- Crèmes solaires et cosmétiques : En raison de sa forte absorption des UV, le TiO₂ est un ingrédient clé des écrans solaires et d'autres produits cosmétiques, offrant une protection contre les rayons UV nocifs.
- Photocatalyse: Les propriétés photocatalytiques duTiO₂le rendent utile dans des applications environnementales telles que la purification de l'air et de l'eau, les surfaces autonettoyantes et les revêtements antibactériens.
- Électronique : Le TiO₂ est utilisé dans la production de composants électroniques, tels que les varistances et les condensateurs, en raison de ses propriétés diélectriques.
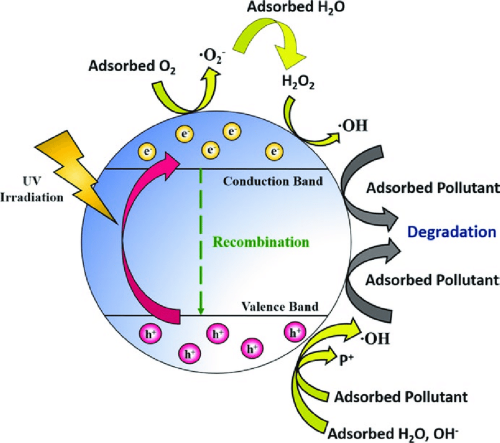 [2]
[2]
2. Monoxyde de titane (TiO)
Couches minces et revêtements : Le TiO est utilisé dans la production de couches minces pour des applications dans les revêtements optiques, les semi-conducteurs et les capteurs. Sa conductivité électrique et sa stabilité thermique lui permettent de répondre à ces besoins.
Impact environnemental et sécurité
Impact sur l'environnement : Bien que le TiO₂ soit généralement considéré comme sans danger pour la santé humaine et l'environnement, son utilisation généralisée suscite des inquiétudes quant à la pollution par les nanoparticules. Les nanoparticules de TiO₂ peuvent pénétrer dans les masses d'eau et avoir un impact potentiel sur la vie aquatique. C'est pourquoi des réglementations et des lignes directrices ont été mises en place pour gérer sa production et son élimination.
Santé humaine : Le TiO₂ est considéré comme non toxique et son utilisation dans l'alimentation, les cosmétiques et les produits pharmaceutiques est réglementée pour garantir la sécurité. Toutefois, l'inhalation de poussières de TiO₂ peut présenter des risques respiratoires, ce qui souligne l'importance d'une manipulation correcte et de mesures de protection dans les environnements industriels.
Activité photocatalytique : Les propriétés photocatalytiques du TiO₂ peuvent conduire à la génération d'espèces réactives de l'oxygène (ROS), qui peuvent avoir des effets bénéfiques et néfastes. Dans les applications environnementales, les ROS peuvent dégrader les polluants, mais une exposition excessive aux ROS peut provoquer un stress oxydatif chez les organismes vivants.
Perspectives d'avenir et recherche
Des recherches sont en cours pour développer des matériaux avancés à base de TiO₂ avec des propriétés améliorées pour des applications dans le stockage de l'énergie, la photovoltaïque et la photocatalyse. Les innovations comprennent le dopage du TiO₂ avec d'autres éléments pour améliorer son efficacité et l'exploration de nouvelles méthodes de synthèse pour un meilleur contrôle de la taille et de la morphologie des particules.
Des efforts sont faits pour développer des méthodes plus durables et plus respectueuses de l'environnement pour la production et l'utilisation des oxydes de titane. Cela inclut l'utilisation des principes de la chimie verte, le recyclage des déchets de TiO₂ et l'amélioration de l'efficacité des processus photocatalytiques.
Conclusion
Les oxydes de titane, en particulier le TiO et le TiO₂, jouent un rôle crucial dans diverses industries. Le TiO, avec son éclat métallique et sa conductivité électrique, est principalement utilisé dans des applications spécialisées telles que les films minces et les revêtements. Quant au TiO₂, connu pour son indice de réfraction élevé, sa forte absorption de la lumière UV, son activité photocatalytique et sa stabilité chimique, il est largement utilisé dans les pigments, les écrans solaires, les cosmétiques, la photocatalyse et l'électronique.
À mesure que la technologie progresse, les oxydes de titane sont appelés à rester à l'avant-garde de la science des matériaux et des applications industrielles. Stanford Advanced Materials (SAM) fournit des produits en titane de haute qualité à des prix compétitifs. Nous proposons de la poudre de nano dioxyde de titane photocatalytique, de la poudre de nano dioxyde de titane pour les batteries au lithium, de la poudre de nano dioxyde de titane pour les céramiques, ainsi que des formes anatase et rutile de dioxyde de titane. Pour plus d'informations, veuillez consulter notre page d'accueil.
|
Aspect |
Monoxyde de titane (TiO) |
|
|
Propriétés |
Poudre blanche et inodore, indice de réfraction élevé, forte absorption de la lumière UV, activité photocatalytique, stabilité chimique, non toxique. |
Éclat métallique, conductivité électrique, structure de sel gemme. |
|
Méthodes de synthèse |
Procédé au sulfate : Réaction de l'ilménite (FeTiO₃) avec l'acide sulfurique, hydrolyse et calcination du sulfate de titane pour obtenir du TiO₂. Procédé au chlorure : Chloration de l'ilménite ou du rutile pour former du TiCl₄, puis oxydation pour produire du TiO₂. Méthode Sol-Gel : Hydrolyse et polymérisation des alcoxydes de titane, suivies d'un séchage et d'une calcination pour obtenir des nanoparticules deTiO₂. |
Méthodes de réduction : Réduction duTiO₂ avec de l'hydrogène ou une combinaison directe de titane et d'oxygène dans des conditions contrôlées. |
|
Applications |
Pigments : Peintures, revêtements, plastiques, papier et encres. Crèmes solaires et cosmétiques : Protection contre les UV. Photocatalyse : Purification de l'air et de l'eau, surfaces autonettoyantes, revêtements antibactériens. Électronique : Varistances, condensateurs. |
Couches minces et revêtements : Revêtements optiques, semi-conducteurs, capteurs. |
Référence :
[1] Pawar, Vani & Kumar, Manish & Dubey, Pawan & Singh, Manish Kumar & Sinha, Ask & Singh, Prabhakar. (2019). Influence de la voie de synthèse sur les propriétés structurelles, optiques et électriques du TiO2. Applied Physics A. 125. 10.1007/s00339-019-2948-3.
[2] Leong, Kah & Ching, Sim & Pichiah, Saravanan & Ibrahim, S. (2016). Nanomatériaux pilotés par la lumière pour l'élimination des toxines agricoles.

 Barres
Barres
 Perles et sphères
Perles et sphères
 Boulons et écrous
Boulons et écrous
 Creusets
Creusets
 Disques
Disques
 Fibres et tissus
Fibres et tissus
 Films
Films
 Flocon
Flocon
 Mousses
Mousses
 Feuille d'aluminium
Feuille d'aluminium
 Granulés
Granulés
 Nids d'abeilles
Nids d'abeilles
 Encre
Encre
 Stratifié
Stratifié
 Grumeaux
Grumeaux
 Mailles
Mailles
 Film métallisé
Film métallisé
 Assiette
Assiette
 Poudres
Poudres
 Tige
Tige
 Feuilles
Feuilles
 Cristaux simples
Cristaux simples
 Cible de pulvérisation
Cible de pulvérisation
 Tubes
Tubes
 Laveuse
Laveuse
 Fils
Fils
 Convertisseurs et calculatrices
Convertisseurs et calculatrices
 Chin Trento
Chin Trento


