Tout ce que vous devez savoir sur les nanoparticules MoO3
Présentation du trioxyde de molybdène
Le trioxyde de molybdène est l'un des oxydes de métaux de transition dont la formule chimique est MoO3(H2O)n (n=0 à 3). Le MoO3 est utilisé dans une large gamme d'applications telles que les photocatalyseurs, l'optique, la détection de gaz, les batteries, les appareils électroniques, etc. Le MoO3 anhydre présente une structure octaédrique "MoO6" déformée, dont la figure 1 représente le cristal orthorhombique. Les sphères vertes représentent le molybdène et les sphères rouges l'oxygène. Le MoO3 possède trois structures cristallines différentes : les phases α-orthorhombique, β-monoclinique et h-hexagonale. Les différentes structures du MoO3 lui confèrent des propriétés physiques et chimiques différentes. Le h-MoO3 présente une stabilité de phase jusqu'à 436℃, mais l'α-MoO3 présente une transition de phase irréversible sous 436℃ [1].

Figure 1 : Structure des octaèdres de MoO6
Comment la nano-structure MoO3 est-elle fabriquée et comment la synthèse par combustion en solution est-elle discutée ?
Il existe plusieurs méthodes de synthèse pour préparer des nanoparticules de trioxyde de molybdène :
Synthèse hydrothermale : les sels de molybdène tels que le molybdate d'ammonium réagissent avec le peroxyde d'hydrogène dans une solution aqueuse à haute température et à haute pression pour former des nanoparticules de MoO3.
Synthèse solvothermique : les sels de molybdène réagissent avec un solvant organique tel que l'éthanol dans un environnement à haute température pour former des nanoparticules de MoO3.
Co-précipitation : une solution de sels de molybdène réagit avec un agent de précipitation, tel qu'un hydroxyde ou un carbonate métallique, à un pH spécifique, et des nanoparticules de MoO3 précipitent à partir de la solution.
Synthèse par combustion de solution : Les sels de molybdène se mélangent à un mélange combustible-oxydant et brûlent à haute température pour former des nanoparticules de MoO3.
Il existe de nombreuses autres méthodes de synthèse qui ne sont pas mentionnées ici. Pour plus d'informations ou d'intérêts, veuillez nous contacter à Stanford Advanced Materials. Même dans une synthèse, différents paramètres conduiront à différents types de structures de nanomoO3. Prenons l'exemple de la synthèse par combustion de solutions.
Dissolvez l'heptamolybdate d'ammonium (NH4)6Mo7O24-4H2O dans de l'eau distillée et mélangez la solution avec un solvant organique (ici, nous utilisons de l'urée, de l'EDTA, du PEG 200 et du sorbitol comme différents additifs organiques pour réaliser les expériences). Chauffez et remuez la solution jusqu'à ce que les précipités se forment. La dernière étape consiste à chauffer les précipités pour éliminer les additifs organiques et les autres impuretés [2].
L'heptamolybdate d'ammonium (AHM) est une grande molécule complexe qui est souvent utilisée comme précurseur dans la production de composés de Mo. L'équation chimique de la solution de synthèse par combustion de l'AHM est la suivante
Le MoO3 peut se former sans aucun additif, mais les additifs jouent un rôle important dans la croissance des cristaux et des noyaux de MoO3. Utilisez un microscope électronique à balayage (MEB) pour détecter les microstructures produites par l'utilisation de différents additifs organiques. Nous obtenons les observations suivantes : L'urée produit une morphologie plus sphérique que les 3 autres additifs. Le PEG 200 produit des nanoparticules sub-micro plus grandes et moins sphériques. Le sorbitol et l'EDTA produisent des nanoparticules très différentes [2]. Ces différences sont dues à la structure chimique des additifs organiques. La figure 2 ci-dessous présente les structures chimiques de ces quatre additifs organiques. L'urée contient de l'azote avec une paire d'électrons non liants. Le PEG200 et le sorbitol ont de l'oxygène dans le groupe OH. L'EDTA possède à la fois des nitrogènes avec une paire d'électrons non liants et de l'oxygène dans le groupe OH. Dans la formation des ligands, l'azote avec 2 électrons libres est plus important que l'oxygène. L'urée attire donc plus facilement le Mo de l'AHM pour former des noyaux de plus petite taille que le PEG200 et le sorbitol [2].
L'EDTA possède 2 atomes d'azote avec 2 électrons libres et 4 atomes d'oxygène dans l'OH. À première vue, il pourrait s'agir de l'additif le mieux adapté à la fabrication de nanoparticules de MoO3. Mais l'EDTA est un composé complexe de très grande taille, comme nous l'avons déjà mentionné. L'effet d'entrave stérique empêche l'azote de l'EDTA d'attirer le Mo. Seul le groupe oxygène intervient dans la structure du ligand et crée les microstructures de MoO3 [2].
Le PEG200 n'a qu'un groupe d'oxygène sur les deux côtés. Il n'est pas aussi attractif que l'urée, ce qui signifie qu'il a peu de chances de former du MoO3 simultanément sur les deux faces. Mais le PEG200 est un composé de structure très simple avec un faible effet d'entrave stérique. Il est plus facile pour le PEG 200 de former un ligand que pour l'EDTA [2].
Lorsque l'un des groupes d'oxygène du sorbitol se lie au Mo, il est impossible pour son autre groupe d'oxygène de se lier à d'autres Mo en raison de sa structure linéaire. En résumé, le sorbitol n'est pas un bon additif pour fabriquer des nanoparticules de MoO3 [2]. D'autres conditions telles que le pH, la température de réaction, la concentration en Mo et le rapport Mo/additif peuvent également affecter les propriétés des nanoparticules de MoO3 produites.
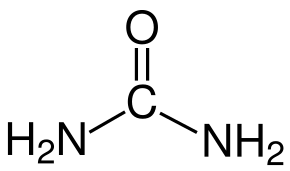
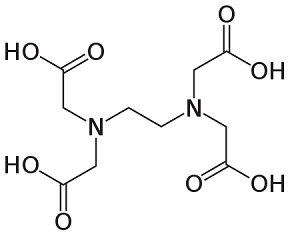
Urée EDTA
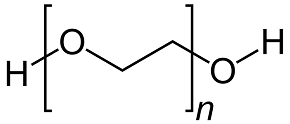
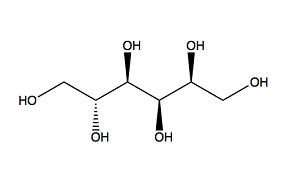
PEG200 Sorbitol
Figure 2 : structures moléculaires des additifs organiques utilisés dans l'expérience
Applications du MoO3
La membrane MoO3 possède de bonnes propriétés électrochromes. Par rapport à d'autres matériaux tels que le WO3 et le TiO2, le MoO3 a un temps de réponse plus court. En outre, le MoO3 devient gris lorsqu'il détecte un stimulus électrique. Sa courbe d'absorption est lisse dans la région visible. Le pic d'absorption se situe près de 550 nm, ce qui est proche de la bande sensible de l'œil humain. La fabrication de MoO3 suprême à l'aide de nanoparticules de MoO3 est l'une des recherches les plus populaires.
Le PVC est un matériau polymère thermoplastique largement utilisé, mais il produit une fumée dense lorsqu'il brûle. Le métal de transition permet une bonne suppression de la fumée. En combinant deux ou plusieurs types de composés de métaux de transition, la fumée dense du PVC peut être sérieusement réduite. Le PVC présente de graves risques d'incendie en raison de l'ajout de plastifiants. Le MoO3 présente également un bon retardateur de flamme. En combinant le MoO3 et le Cu2O, on obtient un effet synergique qui permet de réduire le coût de l'additif MoO3 pur et de conserver les bonnes propriétés des câbles.
Le MoO3 est un photocatalyseur très efficace. Contrairement au traitement traditionnel des eaux usées, les nanoparticules photocatalytiques peuvent convertir les polluants en produits inoffensifs tels que le CO2 [3]. Les nanoparticules confèrent au MoO3 une plus grande surface de contact, ce qui accélère la vitesse de dégradation.
Le MoO3 est un semi-conducteur de type n qui peut être utilisé dans de nombreuses applications telles que la détection de gaz. Les détecteurs de gaz à oxyde métallique "transfèrent" le gaz en électricité, ce qui est plus rapide et plus simple que les autres détecteurs. Contrairement aux autres détecteurs de gaz à oxyde métallique, le MoO3 est un matériau semi-conducteur à large bande interdite dont la surface comporte des sites actifs qui réagissent sélectivement avec le gaz à mesurer. Le MoO3 est très sensible aux gaz. Il est sensible au NH3, au H2, au CO et à d'autres gaz à environ 450℃. La membrane de MoO3 pure ne fonctionne pas bien en raison de sa température et de sa sélectivité très sensibles. La combinaison avec d'autres matériaux permet d'améliorer la capacité de MoO3 à être sensible aux gaz. Par exemple, la combinaison de MoO3 avec V2O5 pour faire des membranes montrent une sensibilité élevée à basse température (environ 150℃) à NO2, NH3, CO, CH4, SO2, et H2.
Il existe de nombreuses applications pour les nanoparticules de MoO3 qui ne sont pas mentionnées. Stanford Advanced Materials (SAM) fournit différents types de MoO3. Si vous souhaitez plus d'informations sur le MoO3, vous pouvez fournir vos informations d'application à notre personnel technique pour obtenir des conseils.
Référence
- Pannipa Wongkrua, Titipun Thongtem, Somchai Thongtem, "Synthesis of h- and α-MoO3 by Refluxing and Calcination Combination : Phase and Morphology Transformation, Photocatalysis, and Photosensitization", Journal of Nanomaterials, vol. 2013, Article ID 702679, 8 pages, 2013. https://doi.org/10.1155/2013/702679
- Parviz, D., Kaz→emeini, M., Rashidi, A. M., & ; Jafari Jozani, K. (2009). Synthèse et caractérisation des nanostructures MOO3 par la méthode de combustion en solution en utilisant le contrôle de la morphologie et de la taille. Journal of Nanoparticle Research, 12(4), 1509-1521. https://doi.org/10.1007/s11051-009-9727-6
- Thekkethil, A. J., Sreekuttan, S., & ; Madhavan, A. A. (2021). Application of nano molybdenum trioxide in thermal storage and photocatalysis (Application du nano trioxyde de molybdène au stockage thermique et à la photocatalyse). Journal of Physics : Conference Series, 2070(1), 012120. https://doi.org/10.1088/1742-6596/2070/1/012120

 Barres
Barres
 Perles et sphères
Perles et sphères
 Boulons et écrous
Boulons et écrous
 Creusets
Creusets
 Disques
Disques
 Fibres et tissus
Fibres et tissus
 Films
Films
 Flocon
Flocon
 Mousses
Mousses
 Feuille d'aluminium
Feuille d'aluminium
 Granulés
Granulés
 Nids d'abeilles
Nids d'abeilles
 Encre
Encre
 Stratifié
Stratifié
 Grumeaux
Grumeaux
 Mailles
Mailles
 Film métallisé
Film métallisé
 Assiette
Assiette
 Poudres
Poudres
 Tige
Tige
 Feuilles
Feuilles
 Cristaux simples
Cristaux simples
 Cible de pulvérisation
Cible de pulvérisation
 Tubes
Tubes
 Laveuse
Laveuse
 Fils
Fils
 Convertisseurs et calculatrices
Convertisseurs et calculatrices
 Chin Trento
Chin Trento



