Comprendre l'empoisonnement des catalyseurs à base de métaux précieux : Causes, problèmes et solutions
1 Introduction
Lescatalyseurs à base de métaux précieux jouent un rôle important dans l'industrie chimique, le secteur de l'énergie et la protection de l'environnement. Grâce à leur structure électronique et à leurs propriétés de surface uniques, les catalyseurs à base de métaux précieux peuvent catalyser efficacement diverses réactions chimiques. Toutefois, dans la pratique, les substances toxiques affectent souvent ces catalyseurs, ce qui entraîne une diminution de l'activité, une altération de la sélectivité et même une réduction de la durée de vie. Pour relever ce défi, ce blog examinera en détail les mécanismes et les applications des catalyseurs à base de métaux précieux, étudiera les causes et les effets de l'empoisonnement des catalyseurs et proposera des mesures pour améliorer leur capacité à résister à l'empoisonnement et leur durée de vie.

Fig. 1 Poudre noire de platine (qualité pile à combustible) fournie par Stanford Advanced Materials
2 Introduction aux catalyseurs à base de métaux précieux
2.1 Mécanismes des catalyseurs à base de métaux précieux
En termes de structure électronique, les métaux nobles (par exemple, le platine, le palladium, le rhodium, l'iridium, etc.) ont des orbitales d'électrons d remplies ou presque remplies. Ces orbitales d'électrons d peuvent effectivement se chevaucher avec les orbitales des molécules réactives, fournissant ainsi l'énergie d'activation nécessaire pour que la réaction puisse être effectuée à une barrière énergétique plus basse. La participation des électrons d permet aux métaux précieux de former des intermédiaires avec une large gamme de réactifs (par exemple, l'hydrogène, l'oxygène, les hydrocarbures, etc. La densité électronique élevée et l'uniformité de la distribution des atomes de métaux précieux donnent une densité élevée de nuages d'électrons à leur surface. Cela permet au catalyseur à base de métaux nobles de fournir ou d'accepter des électrons dans la réaction, jouant ainsi le rôle d'un bon donneur ou accepteur d'électrons et favorisant la réaction.
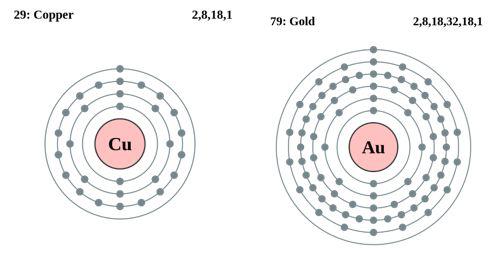
Fig. 2 Arrangements périphériques des électrons des atomes de cuivre et d'or
Du point de vue des propriétés de surface, la surface du métal précieux possède une forte capacité d'adsorption, qui permet d'adsorber efficacement les molécules réactives. Cette capacité d'adsorption provient principalement de la forte interaction entre les atomes de métaux précieux et de la forte activité des atomes de surface. Les catalyseurs à base de métaux précieux peuvent interagir avec les molécules réactives par adsorption physique et chimique, en fournissant des sites actifs pour favoriser la réaction. Les surfaces des catalyseurs à base de métaux précieux ont également une bonne capacité de reconstruction. Au cours du processus de réaction, la surface des atomes de métaux précieux peut subir un certain degré de reconstruction pour s'adapter à l'adsorption et à la réaction de différentes molécules de réactifs. Cette capacité de remodelage de la surface aide le catalyseur à maintenir une activité catalytique efficace dans différentes conditions de réaction.
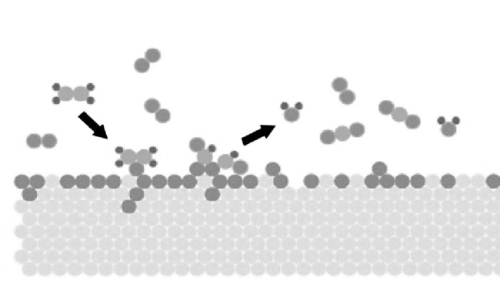
Fig. 3 Schéma de la réaction des molécules de gaz adsorbées à la surface des métaux précieux
En outre, les métaux précieux présentent une grande stabilité thermodynamique et peuvent conserver leur structure et leur activité catalytique à des températures élevées et dans des environnements chimiques difficiles. Cela permet aux catalyseurs à base de métaux précieux de présenter une excellente durabilité et stabilité dans une large gamme de réactions industrielles (par exemple, le craquage à haute température, les réactions d'oxydation, etc.)
Les catalyseurs à base de métaux précieux sont capables de catalyser de nombreux types de réactions, notamment l'hydrogénation, l'oxydation, la disproportion, le couplage, etc. Cette polyvalence est principalement due à l'abondance de leurs sites actifs de surface et à la souplesse de leurs structures électroniques, qui permettent aux métaux précieux de s'adapter à différents mécanismes et conditions de réaction. Différents types de métaux précieux peuvent également former des alliages avec d'autres métaux afin de réguler davantage leurs structures électroniques et leurs propriétés de surface. Par exemple, les catalyseurs à base d'alliages de platine et de palladium présentent des performances catalytiques supérieures à celles des métaux simples dans certaines réactions. L'alliage peut optimiser l'activité, la sélectivité et la stabilité des catalyseurs à base de métaux précieux, améliorant ainsi leur performance globale.
2.2 Applications des catalyseurs à base de métaux précieux
Les catalyseurs à base de métaux précieux sont utilisés dans le traitement des gaz pour protéger l'environnement grâce à leur effet catalytique sur les réactions gazeuses. Les catalyseurs ternaires couramment utilisés dans le traitement des gaz d'échappement des automobiles utilisent le platine (Pt), le palladium (Pd) et le rhodium (Rh) comme principaux composants pour convertir le monoxyde de carbone (CO), les oxydes d'azote (NOx) et les hydrocarbures imbrûlés (HC) présents dans les gaz d'échappement des automobiles en dioxyde de carbone (CO2), en azote (N2) et en eau (H2O) inoffensifs. Le platine et le palladium sont également utilisés dans les systèmes de traitement des gaz d'échappement des moteurs diesel pour oxyder les particules de carbone et les oxydes d'azote émis par ces moteurs. Le traitement des gaz d'échappement dans les usines chimiques industrielles et les raffineries utilise également des catalyseurs à base de métaux précieux tels que le platine et le palladium, qui peuvent éliminer efficacement les composants nocifs des gaz d'échappement. Les capteurs chimiques basés sur des catalyseurs à base de métaux précieux sont utilisés pour détecter les polluants gazeux, les gaz toxiques et les biomolécules dans l'environnement, par exemple les capteurs d'hydrogène et les capteurs de formaldéhyde. Les catalyseurs à base de métaux précieux sont également utilisés pour la dégradation des polluants, comme la dégradation photocatalytique des polluants organiques dans le traitement de l'eau, et les catalyseurs composites d'oxydes de platine et de titane dans l'hydrolyse photocatalytique de l'eau pour la production d'hydrogène.
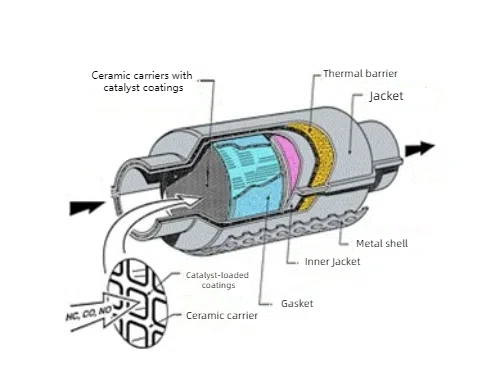
Fig. 4 Structure du convertisseur catalytique à trois voies
Dans le domaine de l'énergie, les catalyseurs à base de métaux précieux, en particulier les catalyseurs à base de platine, sont utilisés dans le processus électrochimique de l'électrolyse de l'eau et dans l'oxydation des piles à combustible au méthanol pour améliorer l'efficacité de la conversion de l'énergie électrique. Dans les piles à combustible à membrane échangeuse de protons (PEMFC), les catalyseurs à base de platine favorisent la réaction électrochimique entre l'hydrogène et l'oxygène au niveau des électrodes pour produire de l'électricité et de l'eau. Les catalyseurs en alliage de platine-ruthénium dans les piles à combustible à méthanol direct (DMFC ) sont utilisés pour oxyder le méthanol et améliorer l'efficacité des piles à combustible. Les électrodes en platine peuvent également être utilisées pour électrolyser l'eau afin de produire de l'hydrogène, ce qui améliore l'efficacité de la réaction. Les catalyseurs à base de métaux précieux sont également utilisés dans la conversion de la biomasse pour transformer les matières premières de la biomasse en produits chimiques et en carburants à haute valeur ajoutée, comme la réaction d'hydrodésoxygénation dans la production de biodiesel.
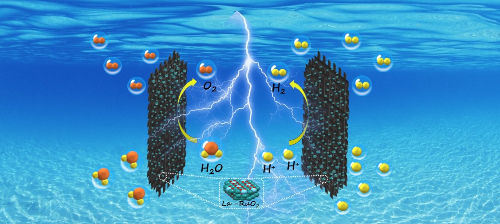
Fig. 5 Production d'hydrogène à partir d'eau électrolytique acide catalysée par La-RuO2 [5]
Dans la production chimique, les catalyseurs à base de métaux précieux sont largement utilisés dans les applications liées à l'organique. Dans l'industrie du raffinage du pétrole, les catalyseurs à base de platine et de palladium peuvent être utilisés dans le processus d'hydrodésulfuration pour éliminer les sulfures du pétrole brut, ce qui peut améliorer la qualité du carburant. Dans le processus de reformage du pétrole, les catalyseurs à base de platine contribuent également à la production d'essence à indice d'octane élevé et de composés aromatiques. Dans l'industrie de la synthèse organique, les catalyseurs à base de platine et de palladium sont largement utilisés pour catalyser les réactions d'hydrogénation, ce qui améliore considérablement l'efficacité du processus d'hydrogénation des doubles et triples liaisons de divers produits organiques. Les catalyseurs au palladium peuvent également catalyser la réaction de couplage de Suzuki et la réaction de Heck, qui jouent un rôle important dans la synthèse de médicaments et la construction de molécules organiques complexes. Dans le domaine de la synthèse des médicaments, les catalyseurs à base de métaux précieux sont souvent utilisés pour des transformations chimiques à des étapes clés, telles que les réactions de couplage croisé catalysées par le palladium, qui jouent un rôle irremplaçable dans la synthèse de molécules médicamenteuses complexes. Les catalyseurs à base de platine et de palladium sont également couramment utilisés dans la catalyse chirale, en catalysant les processus de réaction d'hydrogénation asymétrique pour produire des intermédiaires médicamenteux chiraux, garantissant ainsi la pureté optique et l'activité biologique des médicaments. Les catalyseurs à base de métaux précieux ont d'importantes applications dans la préparation de nanomatériaux, comme l'utilisation de catalyseurs en platine et en or pour préparer des nanomatériaux de haute performance destinés à être utilisés dans des dispositifs électroniques et optoélectroniques.
3 Empoisonnement des catalyseurs
3.1 Définition de l'empoisonnement par catalyse
L'empoisonnement du catalyseur désigne la perte ou la réduction significative de l'activité catalytique d'un catalyseur au cours d'une réaction chimique en raison de la présence de certaines substances (connues sous le nom de poisons ou de substances toxiques). Ces poisons sont fortement chimisorbés ou réagissent avec les sites actifs du catalyseur, empêchant ainsi le catalyseur d'entrer en contact et de réagir normalement avec les réactifs. L'empoisonnement du catalyseur est un phénomène défavorable qui conduit à une réduction de l'efficacité de la réaction chimique, voire à son arrêt complet.
3.2 Causes et types d'empoisonnement du catalyseur
Il existe trois mécanismes principaux d'empoisonnement du catalyseur.
1. Adsorption chimique: Forte adsorption chimique de molécules de poison sur les sites actifs du catalyseur, de sorte que ces sites ne peuvent plus continuer à réagir avec les réactifs.
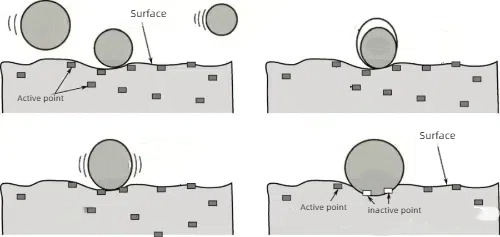
Fig. 6 Principe schématique de la chimisorption
2. Réaction chimique: Le toxique réagit avec les composants actifs du catalyseur pour produire des composés inactifs qui recouvrent la surface du catalyseur.
3. Blocage physique: Certains poisons forment des dépôts à la surface du catalyseur, bloquant physiquement les pores ou les sites actifs du catalyseur.
La désactivation causée par l'empoisonnement du catalyseur est différente en raison de causes et de degrés différents.
1. Empoisonnement temporaire (empoisonnement réversible): Lorsque le poison est adsorbé ou combiné chimiquement sur le centre actif, la force de liaison générée est relativement faible et des méthodes appropriées peuvent être adoptées pour éliminer le poison, de sorte que l'activité du catalyseur peut être rétablie sans affecter la nature du catalyseur ; ce type d'empoisonnement est appelé empoisonnement réversible ou empoisonnement temporaire.
2. Empoisonnementpermanent (empoisonnement irréversible): Le poison interagit avec les composants actifs du catalyseur pour former une liaison chimique très forte, et il est difficile d'éliminer le poison d'une manière générale pour restaurer l'activité du catalyseur ; ce type d'empoisonnement est appelé empoisonnement irréversible ou empoisonnement permanent.
3. Empoisonnementsélectif: Après empoisonnement, le catalyseur peut perdre sa capacité catalytique pour une certaine réaction, mais conserver une activité catalytique pour d'autres réactions ; ce phénomène est appelé empoisonnement sélectif. Dans une série de réactions, si le poison ne provoque que l'empoisonnement du site actif de la réaction suivante, la réaction peut rester au stade intermédiaire et obtenir un rendement élevé de produits intermédiaires.
4 Problèmes causés par l'empoisonnement du catalyseur
4.1 Réduction de l'activité du catalyseur
1. Occupation des sites actifs: Les toxines se chimisorbent fortement ou réagissent avec les sites actifs à la surface du catalyseur, ce qui entraîne l'occupation de ces sites par la toxine et empêche l'adsorption et la réaction des molécules réactives, ce qui entraîne une réduction significative de l'activité du catalyseur. Par exemple, les sulfures (par exemple, H2S) réagissent avec la surface des catalyseurs en platine ou en palladium pour former du sulfure de platine ou du sulfure de palladium, rendant ainsi ces sites actifs inutilisables.
2. Couverture de la surface: Les toxines forment une couche de recouvrement à la surface du catalyseur qui empêche physiquement les réactifs d'atteindre les sites actifs du catalyseur. Cet effet de couverture réduit également considérablement la surface effective du catalyseur et diminue son activité. Par exemple, les phosphates forment une couche de recouvrement à la surface de certains catalyseurs qui empêche les réactifs de s'adsorber.
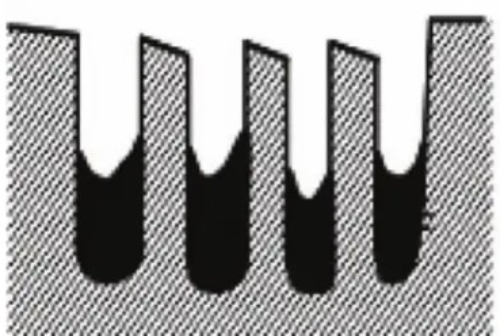
Fig. 7 Structure du catalyseur passivée après couverture de la surface
4.2 Modifications sélectives
1. Occupation spécifique des sites actifs
Certains toxiques se lient sélectivement à des sites actifs spécifiques, ce qui entraîne une modification de l'activité et de la fonction de ces sites. Par exemple, certaines réactions peuvent dépendre de types spécifiques de sites actifs (par exemple, des sites situés sur certains plans cristallins ou dans des arrangements atomiques spécifiques), et l'adsorption de substances toxiques occupera préférentiellement ces sites, modifiant ainsi la sélectivité globale du catalyseur.
Par exemple, dans l'hydrogénation sélective de l'éthylène, les catalyseurs au Pd présentent une sélectivité élevée, mais si la surface du catalyseur est empoisonnée par du soufre (S), les atomes de soufre s'adsorberont de préférence sur les sites actifs de la surface du Pd, ce qui modifiera les propriétés de surface du catalyseur et entraînera une réaction plus encline à produire de l'éthane indésirable plutôt que de l'éthylène.
2. Modification de la voie de réaction
La présence d'un toxique peut modifier la trajectoire d'une réaction catalysée, même s'il n'occupe pas entièrement le site actif, en modifiant les propriétés électroniques ou géométriques de la surface du catalyseur, rendant plus difficile la formation de certains intermédiaires ou états de transition ou plus probable leur décomposition, ce qui oriente la réaction vers un produit différent.
Un exemple typique est la modification de la densité électronique à la surface d'un catalyseur au rhodium (Rh) après empoisonnement du catalyseur par le phosphore (P) dans la réaction d'hydroformylation du propylène, qui entraîne un déplacement du principal produit généré du n-butyraldéhyde vers l'isobutyraldéhyde, une modification de la sélectivité due à l'effet stabilisateur différent du phosphore sur les intermédiaires de la réaction.
3. Remodelage de la surface et modifications géométriques
L'adsorption de substances toxiques à la surface du catalyseur peut entraîner un réarrangement ou un remodelage des atomes ou des molécules à la surface du catalyseur, ce qui modifie la géométrie de la surface du catalyseur et affecte donc l'adsorption et les voies de réaction des molécules réactives. Ces changements géométriques peuvent entraîner une diminution ou une perte totale de sélectivité pour certaines réactions spécifiques.
Dans la réaction de synthèse Fischer-Tropsch, les catalyseurs à base de fer (Fe) sont utilisés pour la synthèse d'hydrocarbures à longue chaîne. Cependant, lorsque la surface du catalyseur en fer est empoisonnée par le soufre, les atomes de soufre provoquent un remodelage de la surface qui diminue la production d'hydrocarbures à longue chaîne et augmente la production de méthane et d'hydrocarbures à chaîne courte. Ce changement de sélectivité est dû à la modification de la structure géométrique des sites actifs à la surface.
Fig. 8 Principe schématique du processus Fischer-Tropsch
4. Changements de stabilité des intermédiaires
La présence de substances toxiques peut modifier la stabilité des intermédiaires réactionnels à la surface du catalyseur, ce qui facilite la désorption ou rend plus difficile la génération de certains intermédiaires, limitant ainsi la distribution du produit final de la réaction.
Dans la réaction d'oxydation du propylène, le catalyseur au molybdène (Mo) est utilisé pour générer de l'acroléine, mais si le catalyseur est empoisonné par le chlore (Cl), le chlore modifie la stabilité des intermédiaires de réaction (par exemple, l'oxyde de propylène), ce qui entraîne une diminution de la sélectivité de la génération d'acroléine et une augmentation de la génération de produits d'oxydation incomplets tels que le dioxyde de carbone.
5. Effet électronique
L'adsorption de substances toxiques modifie l'environnement électronique à la surface du catalyseur, ce qui affecte l'énergie d'adsorption et les barrières énergétiques de réaction des réactifs. En particulier lorsque le toxique est fortement électronégatif ou peut former une différence de densité électronique avec la surface du métal, cet effet électronique peut modifier de manière significative la sélectivité de la réaction du catalyseur.
Dans la réaction d'oxydation partielle du méthanol, les catalyseurs en or (Au) sont utilisés pour générer du formaldéhyde, mais en présence d'oxygène (O2) ou d'oxydes (par exemple, l'alumine), les atomes d'oxygène adsorbés modifient la densité électronique à la surface des catalyseurs en or, ce qui entraîne une oxydation supplémentaire du formaldéhyde en acide formique ou même en dioxyde de carbone, ce qui réduit la sélectivité du formaldéhyde.
4.3 Réduction de la durée de vie du catalyseur
Les phénomènes d'empoisonnement sont souvent irréversibles, en particulier lorsque le toxique réagit fortement avec le catalyseur pour produire un composé stable. Cette désactivation irréversible signifie que le catalyseur ne peut pas retrouver son activité après une longue période par des traitements simples (par exemple, régénération), ce qui réduit considérablement la durée de vie du catalyseur.
En outre, l'action des poisons peut entraîner des modifications de la structure de la surface du catalyseur, voire provoquer l'agglomération ou le frittage des particules de catalyseur, ce qui réduit encore la stabilité et la durée de vie du catalyseur.
4.4 Augmentation des coûts du processus
Le phénomène de toxication entraînant une réduction de l'activité et de la durée de vie du catalyseur, le procédé nécessite un remplacement ou une régénération plus fréquents du catalyseur, ce qui augmente les coûts de production. En outre, des prétraitements complexes des matières premières, tels que la désulfuration et la déphosphoration, peuvent être nécessaires avant la réaction pour réduire les effets de la toxication, ce qui augmente encore les coûts d'exploitation et les investissements en équipements.
5 Mesures de lutte contre l'empoisonnement du catalyseur
5.1 Modification du catalyseur
1. Alliage : L'alliage est la formation de catalyseurs alliés aux propriétés améliorées en combinant des métaux précieux avec d'autres métaux. Cette méthode est efficace pour améliorer la résistance du catalyseur à la toxicité. Par exemple, le palladium (Pd) est allié à d'autres métaux tels que l'or (Au) ou l'argent (Ag) pour améliorer sa résistance aux composés sulfurés et azotés.
Les sulfures sont l'un des poisons les plus courants des catalyseurs, en particulier dans le raffinage du pétrole et les processus chimiques. En alliant le palladium (Pd) à l'or (Au) ou à l'argent (Ag), la résistance d'un catalyseur aux sulfures peut être considérablement améliorée. Par exemple, les catalyseurs alliés palladium-or offrent une meilleure résistance à l'empoisonnement par les sulfures que les catalyseurs au palladium pur, car la présence d'or modifie la structure électronique de la surface du catalyseur et réduit l'adsorption de soufre, ralentissant ainsi le taux d'empoisonnement.
Les nitrures sont également l'une des principales sources d'empoisonnement des catalyseurs, en particulier dans les réactions de synthèse de l'ammoniac et de dénitrification. En alliant le palladium à d'autres métaux tels que le cuivre Cu ou le platine Pt, la tolérance du catalyseur aux nitrures peut être améliorée. L'alliage peut ajuster la densité électronique et la géométrie de la surface du catalyseur, réduire la force d'adsorption des nitrures et retarder la désactivation du catalyseur.
2. Modification de la surface: Modification de la surface du catalyseur, telle que l'ajout d'une couche d'oxyde ou de carbone à la surface du catalyseur à base de métaux nobles, afin d'empêcher les poisons d'entrer directement en contact avec les sites actifs. Par exemple, le revêtement d'oxyde et la modification de la couche de carbone.
L'ajout d'un revêtement d'oxyde, tel que l'oxyde d'aluminium (Al2O3)ou le dioxyde de silicium (SiO2), à la surface d'un catalyseur à base de métal précieux peut améliorer la résistance du catalyseur à la toxicité. Par exemple, un revêtement d'alumine sur la surface d'un catalyseur au palladium peut bloquer efficacement le contact des sulfures avec les sites actifs de la surface du palladium, améliorant ainsi la résistance aux sulfures du catalyseur au palladium. En outre, le revêtement d'oxyde peut fournir des sites acides ou basiques supplémentaires, ce qui améliore encore la sélectivité et l'activité du catalyseur.
L'ajout d'une couche de carbone à la surface d'un catalyseur à base de métaux précieux est également une méthode efficace de modification de la surface. La couche de carbone peut empêcher le contact direct des substances toxiques avec les sites actifs du catalyseur grâce à l'adsorption et au blindage. Par exemple, en déposant une couche de graphène ou de carbone activé à la surface d'un catalyseur au palladium, on peut améliorer sa tolérance aux sulfures et aux nitrures tout en maintenant une bonne activité catalytique. La modification de la couche de carbone améliore non seulement la résistance du catalyseur à la toxicité, mais aussi sa stabilité thermique et sa résistance mécanique.
5.2 Prétraitement des matières premières
Le prétraitement des matières premières est une étape clé pour éviter l'empoisonnement des catalyseurs par les métaux précieux. Grâce à un traitement efficace de désulfuration, de déphosphoration et de dénitrogénation, l'effet du poison sur le catalyseur peut être considérablement réduit, la durée de vie du catalyseur peut être prolongée et ses performances catalytiques efficaces peuvent être maintenues.
1. Désulfuration: La désulfuration fait référence à l'élimination des sulfures de la charge d'alimentation avant la réaction afin d'empêcher l'empoisonnement du catalyseur par les sulfures. Les sulfures sont l'un des poisons les plus courants des catalyseurs, en particulier dans le raffinage du pétrole et la production chimique, où ils réagissent avec les sites actifs à la surface du catalyseur, entraînant sa désactivation. L'hydrodésulfuration est une technologie de désulfuration courante qui élimine le sulfure d'hydrogène de la matière première en réagissant avec le sulfure à haute température et à haute pression à l'aide d'un gaz hydrogéné contenant de l'hydrogène pour convertir le sulfure en sulfure d'hydrogène (H₂S).Cette méthode permet d'éliminer efficacement les composés organosulfurés tels que les mercaptans, les thioéthers et les thioesters de la matière première, réduisant ainsi l'effet toxique de ces sulfures sur le catalyseur.
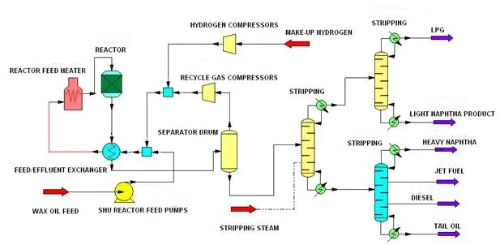
Fig. 9 Processus d'hydrodésulfuration
2. Déphosphoration: le phosphure est également l'une des principales sources d'empoisonnement du catalyseur, en particulier dans certaines réactions catalytiques, le phosphure réagit avec la surface du catalyseur, ce qui entraîne une défaillance du site actif. Il est donc essentiel d'utiliser un agent déphosphorant pour déphosphorer la matière première. Un agent déphosphorant est un réactif chimique spécialement conçu pour éliminer le phosphure de la matière première. L'agent déphosphorant réagit avec les phosphures présents dans la matière première pour former un précipité solide insoluble dans la matière première et les éliminer ainsi. Par exemple, dans certains procédés industriels, des agents déphosphorants à base de calcium peuvent être utilisés pour réagir avec les phosphates et former des précipités de phosphate de calcium, ce qui permet d'atteindre l'objectif de la déphosphoration.
3. Dénitrogénation: Les composés contenant de l'azote sont également l'une des principales causes d'empoisonnement des catalyseurs, en particulier dans les réactions pétrochimiques et de synthèse organique, où les composés azotés se combinent avec les sites actifs du catalyseur, entraînant la désactivation de ce dernier. Pour éviter cela, il est nécessaire de dénitrifier la matière première. Les composés azotés sont également l'une des principales causes d'empoisonnement des catalyseurs, en particulier dans les réactions de synthèse pétrochimique et organique, où les nitrures se combinent avec les sites actifs du catalyseur, entraînant la désactivation de ce dernier. Pour éviter cette situation, la dénitrification des matières premières est nécessaire.
5.3 Optimisation des conditions de réaction
1. Contrôle de la température de réaction: la température de réaction a une influence directe sur l'activité et la stabilité du catalyseur. Le comportement d'adsorption et de désorption des réactifs et des intermédiaires, ainsi que le taux de génération des poisons, changent en fonction des conditions de température. L'optimisation de la température de réaction permet de réduire la production et l'adsorption de substances toxiques. Le fait d'effectuer la réaction à des températures plus basses réduit la production de certains sous-produits toxiques. De nombreux produits toxiques (par exemple, les sulfures, les phosphures) se forment plus facilement à des températures plus élevées, et l'abaissement de la température de réaction peut inhiber la formation de ces sous-produits. Par exemple, dans le processus d'hydrodésulfuration (HDS), la production de sulfure d'hydrogène (H₂S) peut être réduite en abaissant la température de réaction, protégeant ainsi le catalyseur de l'empoisonnement par le sulfure. Les basses températures permettent de réduire l'adsorption des poisons sur la surface du catalyseur. Les températures élevées augmentent l'énergie cinétique des réactifs et des poisons, ce qui facilite leur chimisorption avec les sites actifs à la surface du catalyseur, ce qui peut entraîner un empoisonnement du catalyseur. En contrôlant la température de réaction, l'adsorption des poisons peut être réduite et le cycle actif du catalyseur peut être prolongé.
2. Contrôle de la pression d'hydrogène: dans la réaction d'hydrogénation, la pression d'hydrogène est un paramètre clé qui affecte directement la vitesse de réaction et la sélectivité du catalyseur. En optimisant la pression d'hydrogène, il est possible de réduire efficacement l'hydrogénation excessive et la formation de poisons, protégeant ainsi le catalyseur à base de métaux précieux contre l'empoisonnement. Dans les réactions d'hydrogénation, une pression d'hydrogène trop élevée peut entraîner une hydrogénation excessive des réactifs et la génération de produits entièrement hydrogénés indésirables. Par exemple, dans une réaction d'hydrogénation partielle d'alcynes, une pression d'hydrogène trop élevée peut entraîner une hydrogénation excessive des alcynes en alcanes au lieu des oléfines, le produit cible. En contrôlant la pression d'hydrogène, le degré d'hydrogénation des réactifs peut être régulé avec précision pour éviter une surhydrogénation, améliorant ainsi la sélectivité de la réaction et protégeant l'activité du catalyseur. La pression d'hydrogène influe également sur la production de poisons. Dans certaines réactions, une pression d'hydrogène excessive peut favoriser l'apparition de réactions secondaires et la génération de sous-produits toxiques. Par exemple, dans l'oxydation partielle du méthane, une pression d'hydrogène excessive peut entraîner une oxydation supplémentaire du formaldéhyde en acide formique ou en dioxyde de carbone, augmentant ainsi la toxicité des poisons pour le catalyseur. En optimisant la pression d'hydrogène, il est possible d'inhiber l'apparition de ces réactions secondaires, de réduire la formation de poisons et de protéger l'activité du catalyseur.
5.4 Régénération du catalyseur
La régénération du catalyseur est un élément important du processus visant à éviter l'empoisonnement des catalyseurs à base de métaux précieux. Les catalyseurs seront inévitablement contaminés par des poisons au cours de leur utilisation, ce qui entraînera une diminution de l'activité catalytique. Grâce à des techniques de régénération appropriées, les poisons présents à la surface du catalyseur peuvent être éliminés et ses performances catalytiques peuvent être rétablies.

Fig. 10 Comparaison de l'aspect de divers catalyseurs avant et après régénération
1. Régénération chimique: Élimination des poisons à la surface du catalyseur par des méthodes chimiques, telles que l'oxydation ou la réduction. Cette méthode comprend généralement un traitement d'oxydation et un traitement de réduction.
Le traitement d'oxydation élimine les substances toxiques à la surface du catalyseur en introduisant de l'oxygène ou d'autres agents oxydants pour oxyder et décomposer les substances toxiques organiques ou d'autres substances oxydables à la surface du catalyseur. Par exemple, pour un catalyseur contaminé par des hydrocarbures, de l'air ou de l'oxygène peut être introduit à une température élevée pour oxyder les hydrocarbures à la surface en dioxyde de carbone et en eau, éliminant ainsi les poisons.
Les traitements de réduction sont effectués sur des catalyseurs contaminés par des poisons réducteurs en introduisant un agent réducteur, tel que l'hydrogène, pour restaurer leur activité. Par exemple, un catalyseur au palladium empoisonné par du sulfure peut être soumis à un traitement de réduction sous atmosphère d'hydrogène afin de convertir le sulfure de palladium à la surface en palladium métallique et en gaz de sulfure d'hydrogène, ce qui permet d'éliminer le poison et de restaurer l'activité du catalyseur.
2. Traitement thermique de régénération: Éliminer les poisons organiques ou les dépôts de coke à la surface du catalyseur par grillage à haute température afin de restaurer l'activité du catalyseur. Cette méthode comprend le grillage et le traitement par pyrolyse.
Le grillage à haute température consiste à traiter le catalyseur à des températures élevées pour éliminer les poisons organiques ou les dépôts de carbone à la surface par décomposition thermique ou combustion. Par exemple, pour un catalyseur empoisonné par des dépôts de coke, le catalyseur peut être traité par torréfaction à haute température pour brûler le coke à la surface, éliminant ainsi les poisons et rétablissant l'activité du catalyseur. La température et la durée du grillage doivent être optimisées en fonction de la nature du catalyseur et du type de poison afin de garantir l'élimination efficace du poison sans endommager la structure du catalyseur.
Le traitement par pyrolyse élimine les poisons en décomposant les poisons organiques à la surface du catalyseur en produits volatils à des températures élevées. Par exemple, pour les catalyseurs empoisonnés par des organophosphates, un traitement par pyrolyse peut être effectué à des températures élevées pour décomposer les phosphures en produits gazeux, ce qui permet d'éliminer les poisons et de restaurer l'activité du catalyseur.
5.5 Utilisation d'inhibiteurs de toxicité sélectifs
L'ajout de co-catalyseurs au système de réaction peut également s'avérer efficace pour protéger les catalyseurs à base de métaux précieux. Par exemple, l'ajout de petites quantités d'oxydes métalliques peut adsorber ou convertir les substances toxiques, protégeant ainsi l'activité du catalyseur. Dans les systèmes catalytiques au palladium, l'ajout de petites quantités d'oxydes de lanthane (La) ou de cérium (Ce) peut améliorer de manière significative la résistance au soufre du catalyseur. Ces oxydes métalliques réagissent avec les substances toxiques et les empêchent de se lier au catalyseur en métal précieux, ce qui prolonge la durée de vie du catalyseur et maintient son efficacité.
5.6 Conception de catalyseurs avancés
1. Catalyseurs à noyau-coquille: Les catalyseurs cœur-coquille sont des catalyseurs dans lesquels le noyau métallique actif est encapsulé dans une couche stable. Un catalyseur cœur-coquille se compose d'un cœur (métal actif) et d'une coquille (couche protectrice). L'enveloppe est généralement constituée d'un matériau stable présentant une bonne résistance à la toxicité, comme les oxydes de silice mésoporeux, les matériaux à base de carbone ou l'alumine. Le matériau de l'enveloppe permet aux réactifs d'atteindre les sites actifs du cœur en concevant des pores et des canaux appropriés, tout en bloquant l'entrée des poisons macromoléculaires. Cette conception structurelle permet au noyau métallique actif de ne passer que par des micropores ou des nanocanaux lorsqu'il entre en contact avec les réactifs, empêchant ainsi efficacement les poisons d'entrer en contact direct et de s'adsorber sur la surface du métal actif. Dans le cas du palladium (Pd), par exemple, les catalyseurs dans lesquels le noyau de palladium est encapsulé dans des oxydes de silicium mésoporeux (SiO2) peuvent être nettement plus résistants à la toxicité. Dans cette structure, le noyau de palladium fournit une activité catalytique efficace, tandis que la couche deSiO2 mésoporeux, grâce à la sélectivité de la taille de ses pores, permet aux petites molécules d'entrer et de réagir avec le noyau de palladium tout en bloquant les poisons des grosses molécules, empêchant ainsi efficacement l'empoisonnement du noyau de palladium.
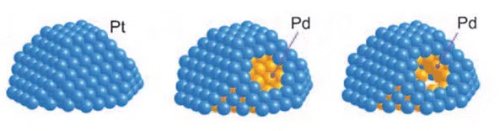
Fig. 11 Structure du catalyseur noyau-coquille Pt-Pd
2. Catalyseurs monoatomiques: Les catalyseurs monoatomiques sont fabriqués en dispersant fortement les atomes de métal actif à la surface du support, de sorte que chaque site actif est constitué d'un seul atome. Cette structure très dispersée maximise l'utilisation des atomes métalliques et augmente considérablement l'activité et la sélectivité du catalyseur. En même temps, comme chaque atome de métal existe indépendamment, il est difficile pour les poisons de s'agréger à sa surface, ce qui réduit le risque d'empoisonnement du catalyseur. Par exemple, les catalyseurs à un seul atome de palladium peuvent être fortement dispersés sur des supports de carbone dopés à l'azote. Chaque atome de palladium est stabilisé sur les sites dopés à l'azote grâce à de fortes interactions, et cette conception permet non seulement de renforcer l'activité catalytique, mais aussi d'améliorer considérablement la résistance du catalyseur aux poisons. Comme il est difficile pour les poisons de s'agréger autour des atomes de palladium individuels, le catalyseur est nettement plus résistant à la toxicité.
5.7 Procédés catalytiques verts
Les mesures spécifiques suivantes peuvent être prises pour réduire le problème de toxicité des catalyseurs conventionnels. Premièrement, utiliser des solvants respectueux de l'environnement tels que des solvants verts comme l'eau ou leCO₂supercritique au lieu de solvants organiques toxiques afin de réduire l'effet d'empoisonnement des poisons sur le catalyseur. Cela permet non seulement d'améliorer la sécurité de la réaction, mais aussi de réduire la pollution de l'environnement. Deuxièmement, de nouveaux systèmes catalytiques sont développés, tels que la recherche et le développement de technologies émergentes comme la catalyse enzymatique ou la photocatalyse. La catalyse enzymatique permet de réaliser des réactions chimiques vertes grâce à la sélectivité et à l'efficacité élevées des enzymes biologiques, tandis que la photocatalyse utilise l'énergie lumineuse pour conduire le processus de réaction et évite le problème d'empoisonnement des catalyseurs traditionnels. Ces approches innovantes améliorent non seulement l'efficacité de la réaction, mais réduisent également l'impact négatif sur l'environnement et la santé.
6 Conclusion
Les catalyseurs à base de métaux précieux jouent un rôle irremplaçable dans l'industrie chimique, la conversion énergétique et la protection de l'environnement en raison de leurs performances catalytiques efficaces et de leur large éventail d'applications. Cependant, la toxicité des catalyseurs limite fortement leur fonctionnement stable à long terme et les effets de leurs applications. Grâce à une étude approfondie du mécanisme des catalyseurs à base de métaux précieux et des causes du phénomène d'empoisonnement, nous pouvons prendre diverses mesures pour améliorer la capacité antipoison et la durée de vie des catalyseurs.
Tout d'abord, la modification des catalyseurs, telle que l'alliage et la modification de la surface, peut améliorer de manière significative la performance anti-empoisonnement des catalyseurs. Deuxièmement, le prétraitement des matières premières et l'optimisation des conditions de réaction peuvent réduire efficacement la production et l'adsorption de substances toxiques. En outre, la régénération du catalyseur et l'utilisation d'inhibiteurs sélectifs de substances toxiques peuvent contribuer à restaurer et à maintenir l'activité du catalyseur. La conception de catalyseurs avancés, tels que les catalyseurs à structure cœur-coquille et les catalyseurs à un seul atome, offre de nouvelles voies pour la lutte contre l'empoisonnement. Enfin, l'application de procédés catalytiques verts contribue non seulement à la réduction des problèmes de toxicité, mais favorise également le processus de développement durable.
En conclusion, les performances et la durée de vie des catalyseurs à base de métaux précieux peuvent être considérablement améliorées par l'application combinée de ces stratégies, répondant ainsi à la demande de catalyseurs efficaces, stables et respectueux de l'environnement dans la production industrielle. Les recherches futures devraient continuer à être consacrées au développement de nouveaux catalyseurs antipoison et de technologies catalytiques vertes afin de promouvoir davantage l'application étendue des catalyseurs à base de métaux précieux dans divers domaines.
À lire aussi :
Applications des catalyseurs à base de métaux précieux : Powder vs. Pellet Insights
Références :
[1] Qin T, Li N, Ma H, et al. Group VIII metals effects on lignite pyrolysis and char gasification with Ca-based catalyst [J]. Fuel,2024,372.
[2] Lysne A, Saxrud I, Snidaro L R, et al. Noble metal (Pt, Pd and Rh) promoted Ni-Co/Mg (Al)O catalysts for steam reforming of tar impurities from biomass gasification [J]. Journal of Catalysis,2024,436.
[3] Nejadmoghadam E, Achour A, Öhrman O, et al. Stabilisation de l'huile de pyrolyse simulée fraîche et âgée par un hydrotraitement doux utilisant des catalyseurs à base de métaux nobles [J]. Energy Conversion and Management,2024,313.
[4] Li L, Chen T, Zhang L, et al. Recent progress of Ni-based nanomaterials as promoter for enhancing the hydrogen evolution reaction performance of noble metal catalysts [J]. Journal of Alloys and Compounds,2024,998.
[5] Yun W, Rui Y, Qiang Z, et al. La-RuO2 nanocrystals with efficient electrocatalytic activity for overall water splitting in acidic media : Effet synergique du dopage La et de la vacance d'oxygène [J]. Chemical Engineering Journal,2022,439.

 Barres
Barres
 Perles et sphères
Perles et sphères
 Boulons et écrous
Boulons et écrous
 Creusets
Creusets
 Disques
Disques
 Fibres et tissus
Fibres et tissus
 Films
Films
 Flocon
Flocon
 Mousses
Mousses
 Feuille d'aluminium
Feuille d'aluminium
 Granulés
Granulés
 Nids d'abeilles
Nids d'abeilles
 Encre
Encre
 Stratifié
Stratifié
 Grumeaux
Grumeaux
 Mailles
Mailles
 Film métallisé
Film métallisé
 Assiette
Assiette
 Poudres
Poudres
 Tige
Tige
 Feuilles
Feuilles
 Cristaux simples
Cristaux simples
 Cible de pulvérisation
Cible de pulvérisation
 Tubes
Tubes
 Laveuse
Laveuse
 Fils
Fils
 Convertisseurs et calculatrices
Convertisseurs et calculatrices
 Écrire pour nous
Écrire pour nous
 Chin Trento
Chin Trento



